SNAKE

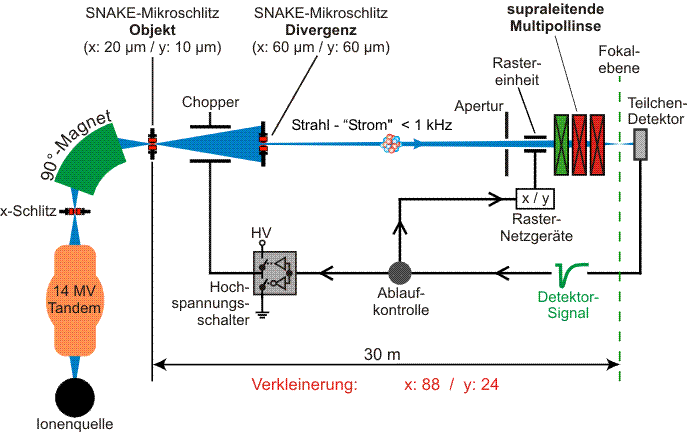
Das am 14MV Münchner Tandembeschleuniger installierte Rasterionenmikroskop SNAKE(Supraleitendes Nanoskop für angewandte kernphysikalische Experimente) erlaubt es, einen Ionenstrahl auf Submikrometergröße zu fokussieren. Mittels speziell entwickelter Objektschlitze wird der Ionenstrahl auf ca. 20 µm Durchmesser beschnitten. Dieses Bild wird durch ein Triplett aus supraleitenden Quadrupollinsen mit Multipolkorrektur je nach Anwendung um einen zwei- bis dreistelligen Faktor verkleinert.
Dies lässt eine Materialanalyse mit üblichen Ionenstrahlanalytiken mit lateraler Auflösung im Submikrometerbereich zu. Darüber hinaus kann mittels elastischer Proton-Proton-Streuung durch Koinzidenzmessungen ein Wasserstoffnachweis mit bis dato unerreichter Sensitivität und geringster Strahlenschädigung an den Proben durchgeführt werden.
Der momentane Einsatzschwerpunkt von SNAKE liegt jedoch in der Strahlenbiologie. Die submikrometergenaue Bestrahlung lebender Zellen mit Einzelionen induziert in der DNA der Zellen diverse Schäden, von denen Doppelstrangbrüche (DSB) die gravierendsten darstellen. An die DSB lagern sich eine Reihe von Reparaturproteinen in Clustern (sogenannte Foci) an, die in fixierten Zellen mittels Immunofluoreszenz unter dem Mikroskop sichtbar gemacht werden können. Aus den Mikroskopaufnahmen lassen sich qualitativ und quantitativ die Dynamik und Kinetik der Proteine aber auch der geschädigten DNA selbst untersuchen. Mithilfe der am Bestrahlungsplatz installierten Lebendzellmikroskopie können Veränderungen in einer Zelle sogar live mitverfolgt werden.
Eine wesentliche Komponente des Rasterionenmikroskops besteht aus einem speziellen Mikro-Schlitzsystem, welches sowohl das Ausgangsobjekt für die ionenoptische Abbildung als auch die Strahldivergenz definiert. Für Zellbestrahlungsexperimente mit einzelnen Ionen besitzt dieses Schlitzsystem eine sehr geringe Transmission von weniger als 10-8 (d.h. nur ein Teilchen von 100 Mio kann das Schlitzsystem passieren). Der so vorpräparierte Ionenstrahl wird dann von einer supraleitenden Multipollinse in die Fokalebene fokussiert. Auf diese Weise erzeugt SNAKE einen Ionen-Strahlfleck mit einer lateralen Ausdehnung von weniger als 0,5 µm (FWHM). Um diesen Strahlfokus über die zu bestrahlende Probe bewegen zu können, befindet sich vor der supraleitenden Linse eine elektrostatische Rastereinheit. Zusätzlich zur starken Strahlreduktion durch das Schlitzsystem ist des weiteren ein schneller Strahl Ein-Aus-Schalter (Chopper) mit Schaltzeiten von ca. 1 µs installiert, sodass Bestrahlungen mit einzelnen Ionen durchgeführt werden können. Ein Detektorsystem registriert dabei jeden Ionentreffer.
Als Standardverfahren zur Kontrolle der gezielten Bestrahlung mit einzelnen Ionen hat sich das Bestrahlen von sog. Kernspurdetektoren (hier: Polycarbonatfolien) etabliert. Die Einschlagsorte von einzelnen Ionen bilden nach dem Ätzen des Detektors kegelförmige Gruben, die im optischen Mikroskop als dunkle Punkte sichtbar werden. Die Kombination von Ionenstrahlrasterung und Präparation einzelner Ionen erlaubt das Bestrahlen von komplexen Mustern bzw. Bildern. In Abbildung 2 ist ein Beispielbild gezeigt, welches durch das Bestrahlen mit über 40000 12C-Ionen der Energie 55 MeV entstanden ist. In der zoom-Ansicht erkennt man die einzelnen Ionentreffer.

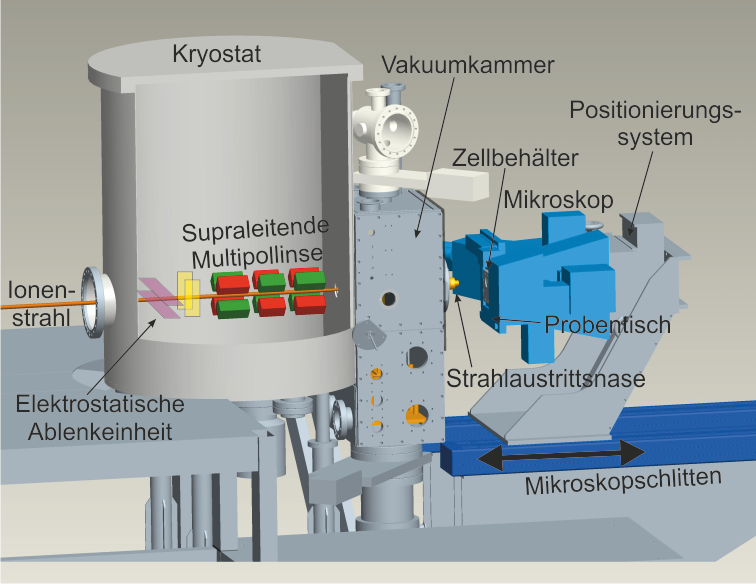
Um lebende Zellen in gleicher Weise mit dem fokussierten Ionenstrahl bestrahlen zu können, ist im Anschluss zur supraleitenden Linse von SNAKE eine entsprechende Bestrahlungsapparatur installiert worden (siehe Abbildung 3). Da die Handhabung der Zellen nur unter Atmosphärendruck möglich ist, muss der Ionenstrahl das Vakuum des Strahlführungssystems verlassen. Dies geschieht am Ende des Austrittsrohrs durch eine Bohrung mit 1 mm Durchmesser, welche von einer 7,5 µm dicken Kaptonfolie (Austrittsfenster) vakuumdicht verschlossen ist. In den Bestrahlungsaufbau ist ein inverses optisches Mikroskop integriert, welches zur optischen Strahlcharakterisierung und Probenpositionierung verwendet wird. Zur Handhabung der lebenden Zellen sind spezielle Behälter entwickelt worden, in denen die Zellen auf einer 6 µm dicken Mylarfolie angewachsen sind. Diese Behälter werden zur Bestrahlung auf dem beweglichen Tisch des optischen Mikroskops befestigt. Die Bauart der Behälter erlaubt dabei die Transmission der hochenergetischen Ionen zum Szintillationsdetektor, der zum Ionennachweis auf dem Objektivrevolver des Mikroskops angebracht ist.